Định nghĩa, Dịch tễ học, Phân loại
Định nghĩa
Khối tân sản thần kinh nội tiết (Neuroendocrine neoplasms – NENs) là những tổ chức tân sản có nguồn gốc từ hệ thống tế bào thần kinh nội tiết, có thể lành tính hoặc ác tính [1].
Dựa trên mức độ ác tính, khối tân sản thần kinh nội tiết chia làm 2 nhóm: U thần kinh nội tiết (neuroendocrine tumors – NETs) và ung thư thần kinh nội tiết (neuroendocrine carcinomas – NECs). NETs là những NENs độ biệt hóa cao, độ tăng sinh thấp; trong khi đó, ngược lại, NECs là những NENs độ biệt hóa thấp và độ tăng sinh cao.
U thần kinh nội tiết hệ tiêu hóa (Gastrointestinal (GI) NETs) là những khối u thần kinh nội tiết có nguồn gốc từ hệ tiêu hóa, lần đầu tiên được biết đến với tên gọi u Carcinoid bởi Oberdorfer năm 1907, nhằm mô tả một dạng u xuất phát từ hệ tiêu hóa nhưng có độ ác tính kém hơn ung thư biểu mô tuyến (adenocarcinoma) [2].
Dịch tễ học
Đây là một nhóm u hiếm gặp với tỷ lệ mắc mới ở Hoa Kỳ là 6.98/10000 người năm 2012, tăng 6.4 lần so với năm 1973. Tỷ lệ lưu hành bệnh tăng từ 0.006% năm 1993 lên 0.048% trong năm 2012 [3]. Tỷ lệ mắc và tỷ lệ lưu hành tăng lên có thể do sự tiến bộ của quá trình chẩn đoán bệnh thông qua nội soi. Một nghiên cứu dựa trên cơ sở dữ liệu SEER (Surveillance, Epidemiology, and End Results database) cho thấy tỷ lệ mắc bệnh theo tuổi trên 100,000 người của u thần kinh nội tiết bắt nguồn từ trực tràng, ruột non, dạ dày, đại tràng, tá tràng, manh tràng và ruột non lần lượt là 0.86, 0.67, 0.30, 0.20, 0.19, 0.16 và 0.15 [4].
Khoảng 20% u thần kinh có liên quan đến các hội chứng di truyền. U thần kinh nội tiết tiêu hóa nhóm bệnh lý di truyền đa u nội tiết tăng sản type 1 (multiple endocrine neoplasia type 1 – MEN1) và u thần kinh xơ hóa type 1 (neurofibromatosis type 1 – NF1). Việc xác định các đột biến di truyền nêu trên có thể ảnh hưởng đến tiên lượng đáp ứng điều trị. Nhóm đột biến này hay gặp ở u thần kinh nội tiết tuyến tụy và tuyến giáp [5], [6]. Với những u thần kinh nội tiết không có đột biến di truyền, việc điều trị dựa trên tính chất khối u. Đa số các khối u <2cm thường có liên quan đến đột biến MEN1, trong khi đó với những khối u kích thước lớn hơn thì mức độ ác tính sẽ cao hơn [7], [8], [9].
65-95% các trường hợp mắc GI – NETs có di căn gan (trừ ruột thừa, dạ dày và trực tràng, khoảng 85 – 90% khối u nguyên phát tại những vị trí này chỉ xuất hiện tại chỗ) [10]. Một số bệnh nhân có cả di căn gan và di căn xương đồng thời. Một nghiên cứu đơn trung tâm cho thấy vị trí gặp di căn xương cao nhất là cột sống (68%), tiếp đến là xương chậu (24%) và xương đùi (12%). Thời gian sống thêm trung vị với nhóm bệnh nhân phát hiện cả di căn gan và di căn xương tính từ thời điểm chẩn đoán là 71.3 tuần [11].
Phân tích dựa trên cơ sở dữ liệu SEER cho thấy thời gian sống thêm trung vị toàn bộ (median overall survival – OS) là 9.3 năm ở Hoa Kỳ. Nhóm khối u có độ biệt hóa tế bào cao có OS cao hơn nhóm khối u có độ biệt hóa trung bình (16.2 so với 8.3 năm). Trong khi đó, nhóm có độ biệt hóa thấp có thời gian sống thêm toàn bộ chỉ là 10 tháng [3].
Theo vị trí, u thần kinh nội tiết trực tràng có tiên lượng tốt nhất, tiếp theo là ruột non, dạ dày và đại tràng [12]. Thời gian sống thêm toàn bộ giảm đi theo tuổi, bệnh nhân trên 70 tuổi có thời gian OS kém hơn nhóm bệnh nhân dưới 70 tuổi (28 tháng so với 233 tháng). 34% bệnh nhân lớn tuổi có di căn xa và 40.8 % ở giai đoạn 3 tại thời điểm phát hiện bệnh [13]. Với nhóm bệnh nhân có di căn, tỷ lệ sống thêm 5 năm thấp (19 – 38%), so với nhóm bệnh tại chỗ, tỷ lệ này là 78 – 93% tùy nghiên cứu [14].
Phân loại
Trước đây u thần kinh nội tiết hệ tiêu hóa được phân loại theo nguồn gốc phôi thai học: Ruột trước (phổi, dạ dày, tá tràng, phần trên ruột non, tụy), ruột giữa (phần dưới ruột non, hồi tràng, ruột thừa, manh tràng), ruột sau (đại tràng và trực tràng) [15]. Trong khi đó, tổ chức y tế thế giới WHO phân loại dựa trên các lớp (Grade) dựa trên tính chất sinh học của khối u (Bảng 1)
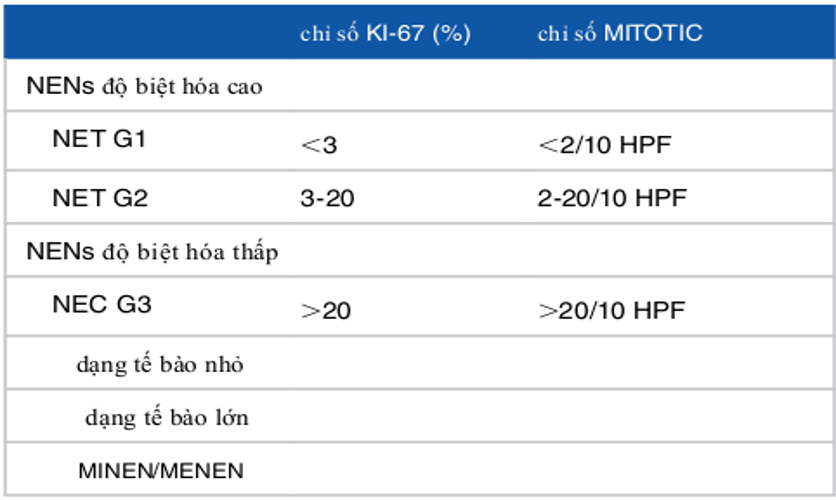
Bảng 1: Phân loại u thần kinh nội tiết tiêu hóa của WHO năm 2017
HPF (High-power field): trường năng lượng cao
MINEN/MENEN (mixed endocrine nonendocrine neoplasms): khối tân sản nội tiết và không chức năng hỗn hợp)
Theo đó, vào năm 2017, WHO đã cập nhật phân loại u thần kinh nội tiết hệ tiêu hóa nhằm mục đích tiên lượng bệnh tốt hơn dựa trên các đặc tính của khối u, bao gồm việc chia phân nhóm NENs độ biệt hóa thấp thành 2 nhóm dựa trên đặc điểm giải phẫu bệnh (Trước đây chỉ được phân loại là nhóm G3), đồng thời đổi tên nhóm ung thư nội tiết – biểu mô tuyến hỗn hợp (mixed adenoneuroendocrine carcinoma – MANEC) thành khối tân sản nội tiết và không chức năng hỗn hợp (mixed endocrine nonendocrine neoplasms – MINEN/MENEN) sau khí nhận thấy trong tổ chức u không chỉ có thành phần ung thư biểu mô tuyến [1]. Khi thành phần u nội tiết chiếm dưới 70% thì khối u đó được phân loại vào nhóm MENEN. Thông thường phân nhóm này thường phát triển từ ruột thừa [16]. Phân nhóm này thường có xu hướng ác tính cao cùng với đó là tiên lượng xấu [17]. Trung vị của thời gian sống thêm toàn bộ của nhóm u thần kinh nội tiết ruột thừa là 6.5 năm so với 13.8 năm của u tế bào hình cốc ruột thừa (appendiceal goblet cell carcinoid) với p < 0.0001 [18].
Một phân loại khác dành riêng cho NENs dạ dày dựa trên tổn thương hình thái và giải phẫu bệnh. Theo đó các khối u thần kinh nội tiết dạ dày được chia làm 3 nhóm: Nhóm 1 là phân nhóm phổ biến nhất và thường phối hợp với bệnh lý viêm dạ dày quá mẫn tự miễn (autoimmune atrophic gastritis); nhóm 2 thường gặp cùng với bệnh lý di truyền đa u nội tiết dạ dày tăng sản type 1 (gastrinoma/MEN-1); và nhóm 3, khá hiếm gặp, thường xuất hiện trên dạ dày bình thường, với pH dạ dày bình thường, thường có hình thái ác tính cao. Các khối u nhóm 3 thường có kích thước lớn, độ xâm lấn sâu hơn 2 nhóm còn lại. Nhóm 4 rất hiếm gặp, có độ biệt hóa thấp và mức độ ác tính cao nhất [19].
Triệu chứng học
Triệu chứng lâm sàng của các khối u NETs xuất hiện dựa trên sự xâm lấn tại chỗ, di căn và từ quá trình bài tiết các chất dạng Hormone.
Triệu chứng đặc hiệu theo vị trí nguyên phát
Các triệu chứng của khối u nguyên phát sẽ đặc hiệu theo vị trí tổn thương. Các khối u NETs dạ dày có chứa các tế bào ECL (enterochromaffin-like cells). Type 1 của u thần kinh nội tiết dạ dày có chứa các kháng thể kháng tế bào viền (antiparietal cell antibodies) hay kháng thế kháng yếu tố nội (anti-intrinsic factor antibodies), từ đó gây ra hiện tượng tăng tiết gastrin thứ phát do tình trạng giảm tính acid dịch vị. Type 2 cũng có triệu chứng tăng tiết gastrin, nguyên nhân do yếu tố tự miễn kích thích. Cả 2 nhóm này đều có triệu chứng như xuất hiện các ổ loét dạ dày, đa polyp dạ dày chảy máu và ung thư dạ dày. Type 3 và 4 có độ ác tính cao hơn, với hình thái gần tương tự với ung thư biểu mô tuyến dạ dày [1].
Các khối u NETs ruột non thường xuất hiện ở đoạn xa hồi tràng, biểu hiện triệu chứng đau đột ngột và bán tắc ruột [20]. Vị trí khối u ở tá tràng gây ra triệu chứng xuất huyết tiêu hóa trên, vàng da, hội chứng khối gây tắc tá tràng với biểu hiện nôn, buồn nôn [21]. Vị trí đại tràng thường xuất hiện triệu chứng đau bụng, chán ăn, gầy sút cân. Cuối cùng, các khối u NETs trực tràng gây ra sự thay đổi thói quen đại tiện và thường khó phân biệt với bệnh trĩ [22], [23].
Hội chứng Carcinoid (Carcinoid Syndrome)
Đây là hội chứng gây ra bởi tình trạng tiết các chất dạng Hormone từ khối u, xảy ra trên khoảng 30 – 40% bệnh nhân với các khối u thần kinh nội tiết độ biệt hóa cao, với tập hợp các triệu chứng kinh điển phù mặt, đi ngoài và co thắt phế quản [24]. Các biến chứng muộn bao gồm tình trạng xơ hóa (xơ hóa van tim, xơ hóa phúc mạc), kém hấp thu dinh dưỡng. Với những khối u NETs ở ruột, hội chứng Carcinoid thường bắt gặp trên những trường hợp có di căn gan, do các chất được khối u bài tiết không được chuyển hóa ở gan mà vào hệ tuần hoàn dưới dạng hoạt động [1].
Cơ chế bệnh học của biến chứng xơ hóa là chưa rõ ràng, có thể do một số chất kích tính tăng sinh mạch như serotonin đã kích thích các nguyên bào sợi [24], [25], [26]. Bệnh lý tim mạch do hội chứng này hầu như chỉ ảnh hưởng đến buồng tim phải, đặc biệt là van ba lá. Bệnh nhân thường không có triệu chứng ở giai đoạn sớm, sau đó sẽ có hội chứng suy tim phải điền hình (phù ngoại vi, cổ chướng,…) [27]. Xơ hóa mạc treo ruột non và phúc mạc là một phản ứng khử mô (desmoplastic reaction) dẫn tới di căn hạch ổ bụng [25], [26]. Di căn phúc mạc gây ra tình trạng xơ hóa tại chỗ, hệ quả là hoại tử mạc treo và xơ hóa sau phúc mạc, từ đó tạo ra các khối u bụng lớn và tắc nghẽn niệu quản [28].
Thông thường, 99% trytophan được sử dụng cho quá trình chuyển hóa nicotinic acid, tạo thành serotonin và beta-nicotinamide adenine dinucleotide (NAD), dạng hoạt động của niacin. Các khối u thần kinh nội tiết sử dụng tới 60% lượng trytophan của cơ thể, từ đó gây ra các triệu chứng thiếu trytophan hay niacin của cơ thể. Triệu chứng thiếu trytophan gây suy nhược thần kinh, còn triệu chứng thiếu niacin gây ra bệnh Pellagra (viêm da, đi ngoài và suy giảm trí nhớ) [24].
Biến chứng cấp tính Carcinoid (Carcinoid crisis)
Đây là biến chứng cấp tính nguy hiểm, biểu hiện bằng một tình trạng rối loạn huyết động xảy ra khi bắt đầu thực hiện một thủ thuật hoặc một phương pháp điều trị đối với những khối u có kích thước lớn hoặc mức độ hoạt động hormon mạnh, hoặc thứ phát trong trường hợp kiểm soát không tốt hội chứng carcinoid [29]. Biến chứng cấp tính Carcinoid quanh mổ được giả thuyết do tình trạng giải phóng đột ngột các hormone khi thao tác vào khối u hoặc gây mê. Tuy nhiên, một số nghiên cứu gần đây cho thấy biến chứng hạ huyết áp cấp tính xảy ra không phải do sự giải phóng đột ngột một lượng lớn serotonin, histamine, kallikrein hoặc bradykinin, mà có thể do một thành phần khác gây ra. Hơn nữa, khi đánh giá các chỉ số tim, áp lực động mạch phổi, hay áp lực tĩnh mạch trung ương cho thấy tình trạng cấp tính này không phải do một hoạt chất gây shock tim phổi nào, mà lại liên quan đến tình trạng giảm thể tích tuần hoàn và áp lực mạch hệ thống [30]. Octreotide, một dạng đồng phân của somatostatin, được dùng trong dự phòng cũng như điều trị cho hội chứng Carcinoid cấp tính. Tuy nhiên việc sử dụng octreotide trước mổ và liều bolus trong mổ không cho thấy ý nghĩa trong việc dự phòng các biến chứng trong mổ khác [31]. Việc sử dụng nhắc lại sau mổ làm giảm thời gian huyết áp tụt, từ đó hạn chế được những biến chứng sau mổ cho bệnh nhân [32]. Hơn nữa, bù dịch và sử dụng các thuốc vận mạch có thế gây ra tình trạng giải phóng hằng loạt hormone sau mổ, từ đó gây lên biến chứng Carcinoid thứ phát sau mổ sau mổ, vì thế, việc sử dụng Octreotide sau mổ càng được khuyến cáo [33].
TÀI LIỆU THAM KHẢO
1. Wang R., Zheng-Pywell R., Chen H.A., et al. (2019). Management of Gastrointestinal Neuroendocrine Tumors. Clin Med Insights Endocrinol Diabetes, 12.
2. Modlin I.M., Shapiro M.D., and Kidd M. (2004). Siegfried oberndorfer: Origins and perspectives of carcinoid tumors. Hum Pathol, 35(12), 1440–1451.
3. Dasari A., Shen C., Halperin D., et al. (2017). Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States. JAMA Oncol, 3(10), 1335–1342.
4. Yao J.C., Hassan M., Phan A., et al. (2008). One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol Off J Am Soc Clin Oncol, 26(18), 3063–3072.
5. Shamila M.A. and Reddy P.S. (2018). Duodenal neuroendocrine tumor, adenocarcinoma and gastrointestinal stromal tumor in association with neurofibromatosis type 1: An unique occurrence. Indian J Pathol Microbiol, 61(3), 401.
6. Gaztambide S., Vazquez F., and Castaño L. (2013). Diagnosis and treatment of multiple endocrine neoplasia type 1 (MEN1). Minerva Endocrinol, 38(1), 17–28.
7. Iyer R., Phan A.T., and Boudreaux J.P. (2017). Recent advances in the management of gastroenteropancreatic neuroendocrine tumors: insights from the 2017 ASCO Gastrointestinal Cancers Symposium. Clin Adv Hematol Oncol HO, 15 Suppl 4(4), 1–24.
8. Falconi M., Plockinger U., Kwekkeboom D.J., et al. (2006). Well-differentiated pancreatic nonfunctioning tumors/carcinoma. Neuroendocrinology, 84(3), 196–211.
9. Partelli S., Bartsch D.K., Capdevila J., et al. (2017). ENETS Consensus Guidelines for Standard of Care in Neuroendocrine Tumours: Surgery for Small Intestinal and Pancreatic Neuroendocrine Tumours. Neuroendocrinology, 105(3), 255–265.
10. Frilling A., Modlin I.M., Kidd M., et al. (2014). Recommendations for management of patients with neuroendocrine liver metastases. Lancet Oncol, 15(1), e8-21.
11. Croome K.P., Burns J.M., G Que F., et al. (2016). Hepatic Resection for Metastatic Neuroendocrine Cancer in Patients with Bone Metastases. Ann Surg Oncol, 23(11), 3693–3698.
12. Man D., Wu J., Shen Z., et al. (2018). Prognosis of patients with neuroendocrine tumor: a SEER database analysis. Cancer Manag Res, 10, 5629–5638.
13. Sackstein P.E., O’Neil D.S., Neugut A.I., et al. (2018). Epidemiologic trends in neuroendocrine tumors: An examination of incidence rates and survival of specific patient subgroups over the past 20 years. Semin Oncol, 45(4), 249–258.
14. Riihimäki M., Hemminki A., Sundquist K., et al. (2016). The epidemiology of metastases in neuroendocrine tumors. Int J Cancer, 139(12), 2679–2686.
15. Williams E.D. and Sandler M. (1963). The classification of carcinoid tum ours. Lancet Lond Engl, 1(7275), 238–239.
16. Brathwaite S., Rock J., Yearsley M.M., et al. (2016). Mixed Adeno-neuroendocrine Carcinoma: An Aggressive Clinical Entity. Ann Surg Oncol, 23(7), 2281–2286.
17. Brathwaite S.A., Smith S.M., Wai L., et al. (2018). Mixed adenoneuroendocrine carcinoma: A review of pathologic characteristics. Hum Pathol, 73, 184–191.
18. Brathwaite S., Yearsley M.M., Bekaii-Saab T., et al. (2016). Appendiceal Mixed Adeno-Neuroendocrine Carcinoma: A Population-Based Study of the Surveillance, Epidemiology, and End Results Registry. Front Oncol, 6.
19. Crown A., Kennecke H., Kozarek R., et al. (2019). Gastric carcinoids: Does type of surgery or tumor affect survival?. Am J Surg, 217(5), 937–942.
20. Strosberg J. (2012). Neuroendocrine tumours of the small intestine. Best Pract Res Clin Gastroenterol, 26(6), 755–773.
21. Murray L., Haley C., Berry-Cabán C.S., et al. (2016). Duodenal neuroendocrine tumor and the onset of severe diabetes mellitus in a US veteran. SAGE Open Med Case Rep, 4.
22. Chung T.P. and Hunt S.R. (2006). Carcinoid and neuroendocrine tumors of the colon and rectum. Clin Colon Rectal Surg, 19(2), 45–48.
23. Khan M., Dirweesh A., Alvarez C., et al. (2017). Anal Neuroendocrine Tumor Masquerading as External Hemorrhoids: A Case Report. Gastroenterol Res, 10(1), 56–58.
24. Rubin de Celis Ferrari A.C., Glasberg J., and Riechelmann R.P. (2018). Carcinoid syndrome: update on the pathophysiology and treatment. Clin Sao Paulo Braz, 73(suppl 1), e490s.
25. Mota J.M., Sousa L.G., and Riechelmann R.P. (2016). Complications from carcinoid syndrome: review of the current evidence. Ecancermedicalscience, 10, 662.
26. Rodríguez Laval V., Pavel M., Steffen I.G., et al. (2018). Mesenteric Fibrosis in Midgut Neuroendocrine Tumors: Functionality and Radiological Features. Neuroendocrinology, 106(2), 139–147.
27. Luis S.A. and Pellikka P.A. (2016). Carcinoid heart disease: Diagnosis and management. Best Pract Res Clin Endocrinol Metab, 30(1), 149–158.
28. Mantzoros I., Savvala N.A., Ioannidis O., et al. (2017). Midgut neuroendocrine tumor presenting with acute intestinal ischemia. World J Gastroenterol, 23(45), 8090–8096.
29. Tapia Rico G., Li M., Pavlakis N., et al. (2018). Prevention and management of carcinoid crises in patients with high-risk neuroendocrine tumours undergoing peptide receptor radionuclide therapy (PRRT): Literature review and case series from two Australian tertiary medical institutions. Cancer Treat Rev, 66, 1–6.
30. Condron M.E., Jameson N.E., Limbach K.E., et al. (2019). A prospective study of the pathophysiology of carcinoid crisis. Surgery, 165(1), 158–165.
31. Massimino K., Harrskog O., Pommier S., et al. (2013). Octreotide LAR and bolus octreotide are insufficient for preventing intraoperative complications in carcinoid patients. J Surg Oncol, 107(8), 842–846.
32. Condron M.E., Pommier S.J., and Pommier R.F. (2016). Continuous infusion of octreotide combined with perioperative octreotide bolus does not prevent intraoperative carcinoid crisis. Surgery, 159(1), 358–365.
33. Seymour N. and Sawh S.C. (2013). Mega-dose intravenous octreotide for the treatment of carcinoid crisis: a systematic review. Can J Anaesth J Can Anesth, 60(5), 492–499.
 UNG THƯ HỌC
UNG THƯ HỌC