6. Các phương pháp điều trị UTDM
Chiến lược điều trị ung thư đường mật dựa trên toàn trạng của bệnh nhân, tình trạng xâm lấn tại chỗ (xâm lấn mạch hay nhu mô gan, có di căn xa hay không, cũng như năng lực cũng như kinh nghiệm của chuyên gia [1]
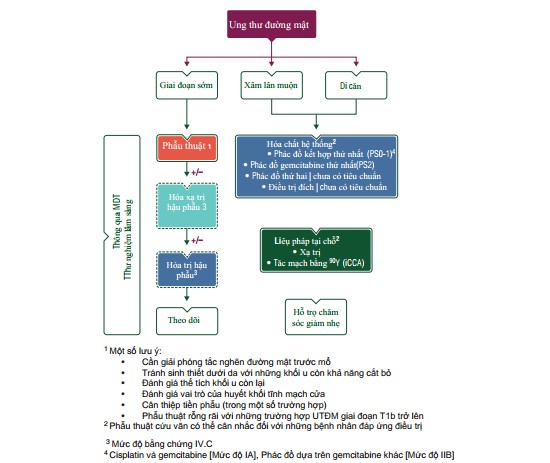
(MDT: Nhóm đa mô thức; PS (performance status): Toàn trạng; iCCA (intrahepatic cho-langiocarcinoma) UTĐM trong gan)
6.1. Điều trị hoá chất và tia xạ.
6.1.1. Xạ trị
Vai trò của xạ trị còn chưa rõ ràng trong những trường hợp u giai đoạn muộn xâm lấn tại chỗ nhưng chưa có di căn xa. Hóa – xạ trị kết hợp có thể cân nhắc theo một số thử nghiệm lâm sàng không ngẫu nhiên với thời gian sống thêm trung vị từ 9 đến 14 tháng. Thử nghiêm lâm sàng pha III FFCD 9902 của Pháp so sánh hóa xạ trị (50 Gy kết hợp với 5-FU và Cisplatin) với hóa chất đơn thuần (Gemcitabine và Oxaiplatin – phác đồ GemOx) [25]. Nghiên cứu cho thấy lợi ích của phác đồ GEMOX trên thời gian sống thêm không bệnh (trung vị 11 tháng so với 5.8 tháng), cũng như thời gian sống thêm toàn bộ (20 tháng so với 13.5 tháng). Gần đây, xạ trị điều biến liều (intensity-modulated radiotherapy – IMRT) đã cho thấy hiệu quả trong việc kiểm soát liều xạ trị [26], góp phần làm tăng khả năng kiểm soát tại chỗ, tuy nhiên lợi ích sống thêm còn chưa được nghiên cứu.
6.1.2. Hóa chất – Điều trị toàn thân
Nhiều nghiên cứu lâm sàng tiến cứu có đối chứng ngẫu nhiên cho thấy điều trị hóa chất toàn thân làm tăng thời gian sống của bệnh nhân giai đoạn tiến triển so với việc chăm sóc giảm nhẹ [27], [28]. Nghiên cứu pha III mang tên ABC-02 của Anh đưa ra phác đồ tiêu chuẩn của UTĐM là Cisplatin/Gemcitabine (Mức độ bằng chứng I,A), đạt dược thời gian sống thêm trung vị là 11.7 tháng so với 8.1 tháng của phác đồ Gemcitabine đơn thuần (95% CI: 0.53-0.79; P<0.001) [29], kết quả cũng tương tự với một thử nghiêm pha II tại Nhật Bản [30]. Một phân tích tổng quan tập hợp kết quả các nghiên cứu này cho thấy lợi ích của phác đồ kết hợp này là độc lập với các yếu tố như tuổi (<65 so với ≥65 tuổi), giới tính, vị trí u nguyên phát (trong gan so với ngoài gan, túi mật so với nhú tá lớn), giai đoạn bệnh (xâm lấn tại chỗ hay di căn xa) và phương pháp điều trị trước đó (phẫu thuật hay đặt stent); tuy nhiên những bệnh nhân vế thứ 2 thường có lợi ích thấp hơn so với vế đầu [31]. Với những bệnh nhân có chức năng thận suy giảm, Oxaliplatin có thể là sự thay thế tốt cho Cisplatin (Mức độ bằng chứng II, B); với những bệnh nhân vế thứ 2, phác đồ Gemcitabine đơn thuần có thể được cân nhắc (mức độ bằng chứng I, B).
Chưa có một phác đồ tiêu chuẩn thứ hai đối với trường hợp tiến triển sau phác đồ đầu tiên, măc dù phác đồ dựa trên fluoropyrimidine (đơn thuần hoặc phối hợp) đôi khi vẫn được sử dụng (mức độ bằng chứng III,C). Một nghiên cứu tổng quan trên 761 bệnh nhân cho thấy kết quả đáng thất vọng về thời gian sống thêm không bệnh (3.2 tháng, 95% CI: 2.7–3.7), tỷ lệ đáp ứng điều trị (7.7%; 95% CI: 4.6–10.9), thời gian sống thêm toàn bộ (7.2 tháng; 95% CI: 6.2–8.2), và không có khuyến cáo nào được đưa ra đối với phác đồ thứ hai phù hợp nhất [32].
6.1.3. Điều trị cá thể (Điều trị đích)
Những kết quả khiêm tốn thu được của hóa trị đã cho thấy nhu cầu của các phương pháp điều trị đích, các receptor phát triển biểu mô (EGFR) và phát triển nội mô mạch máu (VEGF) vẫn đang được nghiên cứu nhiều nhất.
Mặc dù có tỷ lệ đáp ứng rất hứa hẹn (63%) khi thêm kháng thể kháng EGFR, cetuximab, vào phác đồ GemOx trong một nghiên cứu đơn (với kết quả 9 bệnh nhân (30%) được thực hiện phẫu thuật cứu vãn) [33], không thu được lợi ích khi thực hiện sự kết hợp này được quan sát trong thử nghiêm lâm sàng ngẫu nhiên pha II BINGO [34], kết quả thu được cũng tương tự khi kết hợp erlotinib hoặc pantitumumab, không có mối tương quan rõ ràng với sự biểu hiện quá mức EGFR hay đột biến k-ras.
Một thử nghiệm lâm sàng pha II nghiên cứu yếu tố VEGF cho thấy thất bại trong việc thu được lợi ích của sorafenib (một chất ức chế tyrosine kinase đường uống) đối với phác đồ gemcitabine đơn thuần [35] hoặc cediranib (chất ức chế tyrosine kinase c-Kit, VEGFR-1, -2 và -3, PDGF) so với phác đồ cisplatin/gemcitabine [36].
Cần hiểu rõ hơn về cơ chế phân tử của UTĐM để xác định liệu pháp điều trị đích thích hợp. Tính chất phân tử có sự khác biệt rõ ràng giữa ung thư cây đường mật và ung thư túi mật, giữa UTĐM trong gan và ngoài gan (VD: Sự sắp xếp lại IDH-1 và FGFR chỉ gặp trong UTĐM trong gan). Ý nghĩa và ứng dụng lâm sàng của những tính chất này còn đang được nghiên cứu.
6.2. Điều trị ít xâm hại.
6.2.1. Dẫn lưu đường mật qua da (đặt stent)
Cùng với chụp đường mật qua da dẫn lưu đường mật qua da cũng đã được áp dụng từ rất lâu trong điều trị UTĐM. Đây chỉ là phương pháp điều trị tạm thời trong những trường hợp không có chỉ định phẫu thuật hoặc chuẩn bị cho phẫu thuật. Sau khi chọc đường mật qua da đặt một catheter (stent) vào trong đường mật để bơm thuốc cản quang chụp đường mật đồng thời dẫn lưu dịch mật.
Năm 1974 Okuda (Nhật bản) dùng kim Chiba vừa bơm thuốc vừa rút kim và kiểm tra hình ảnh đường mật trên màn tăng sáng cho tỷ lệ thành công cao (trong đó với đường mật bình thường đạt 71,9%, với đường mật dãn đạt 100%) và tỷ lệ biến chứng giảm, chỉ còn 1,06% [37].
6.2.2. Dẫn lưu đường mật qua nội soi mật tuỵ ngược dòng (đặt stent)
Cũng như dẫn lưu đường mật qua da đây cũng chỉ là phương pháp điều trị tạm thời. Qua nội soi mật tuỵ ngược dòng đặt một stent qua Oddi vào ống mật chủ để dẫn lưu mật xướng tá tràng. Tỷ lệ thành công từ 90 đến 94%, tuy nhiên phương pháp này cũng có biến chứng từ 1 đến 15% tuỳ theo từng người soi, hay gặp là nhiễm trùng đường mật và viêm tuỵ cấp là hai biến chứng hay gặp nhất với tỷ lệ tử vong là 0,5 đến 1% [38] [20] .
6.3. Điều trị phẫu thuật.
6.3.1. Điều trị triệt để
Hiện nay biện pháp điều trị có hiệu quả nhất là phẫu thuật cắt bỏ u. Nhưng do phần lớn các bệnh nhân thường đến ở giai đoạn muộn nên tỷ lệ phẫu thuật triệt căn còn ít, Theo các tác giả Mỹ là 40 đến 50% [39]. Chống chỉ định chủ yếu của việc cắt bỏ là di căn phúc mạc và di căn xa. Để tăng cường khả năng cắt bỏ gan trong điều trị UTĐM các tác giả Nhật Bản đã chủ trương làm tắc tĩnh mạch gan trước mổ [40]. Các tác giả châu Âu lại chủ trương ghép gan cho những bệnh nhân khó có khả năng cắt bỏ [41]. Trong một nghiên cứu lớn, tỷ lệ phẫu thuật triệt để của UTĐM đoạn xa, trong gan và u Klaskin lần lượt là 91, 60 và 56% [42].
Tiêu chuẩn cơ bản về khả năng cắt bỏ của UTĐM nói chung bao gồm [40], [43]:
Không có di căn nhóm hạch quanh tụy hoặc quanh động mạch chủ, cũng như không có di căn gan xa.
Không có di căn tĩnh mạch cửa cũng như động mạch gan chung (Tuy nhiên một số trung tâm vẫn thực hiện chiến lược cắt đoạn mạch xâm lấn cùng tạo hình mạch [44], [45].
Không có di căn tạng ngoài gan.
Không có bệnh truyền nhiễm kèm theo
Tùy vào vị trí khối u mà có thêm các tiêu chuẩn khác. Ví dụ: tiêu chuẩn về khả năng không thể cắt bỏ của u Klaskin bao gồm xâm lấn đến các phân nhánh thứ hai của cây đường mật, xâm lấn đến đoạn xa của tĩnh mạch cửa (chỗ hợp lưu của TM lách và TM MTTT), teo một thùy gan cùng với xâm lấn nhánh tĩnh mạch cửa bên đối diện hoặc phân nhánh thứ hai của cây đường mật bên đối diện, hoặc phân nhánh thứ hai của động mạch gan [12], [46].
Phương pháp điều trị ECC dựa vào vị trí của u và di căn hạch [45]:
- 1/3 dưới: Cắt khối tá tuỵ (DPC) là phẫu thuật được lựa chọn.
- 1/3 giữa: cắt bỏ rộng rãi + nạo vét hạch + cắt túi mật + có thể kèm theo cắt gan hoặc DPC.
- 1/3 trên: Cắt bỏ đường mật ngoài gan kèm cắt gan.
Riêng đối với u Klastkin theo phân loại của Bismuth phác đồ điều trị như sau [47]:
Type I và II: cắt bỏ u (đường mật và túi mật với diện cắt cách u từ 5-10 mm) và hạ phân thuỳ I [48].
Type III: Cắt bỏ u, cắt gan phải (IIIA), cắt gan trái (IIIB) hoặc cắt gan phải cắt đường mật ngoài gan + cắt khối tá tuỵ (IIIA), cắt gan trái cắt đường mật ngoài gan + cắt khối tá tuỵ (IIIB).
Type IV: cắt gan trung tâm hoặc ghép gan.
Việc cắt bỏ hạ phân thuỳ I hệ thống đối với u Klastkin đã cho thời gian sống sau 5 năm dài hơn là không cắt bỏ [47], [48].
6.3.2. Điều trị tạm thời.
Điều trị tạm thời chỉ nhằm mục đích dẫn lưu mật trong những trường hợp u không còn khả năng cắt bỏ gây tắc mật. Có hai nhóm phương pháp chính là nhóm nối tắt mật – ruột (thích hợp cho những trường hdợp mổ mở phát hiện u không còn khả năng cắt bỏ) và nhóm đặt stent đường mật (thích hợp cho những trường hợp nội soi hoặc soi dạ dày tá tràng phát hiện u không còn khả năng cắt bỏ) :
- Nối túi mật với hỗng tràng.
- Nối rốn gan với hỗng tràng.
- Nối các ống gan với hỗng tràng (có thể cắt gan hoặc không): thông thường sẽ nối ống gan hạ phân thùy IV-II/III, trong một số trường hợp có thể nối ống gan hạ phân thùy V để dẫn lưu gan phải, tuy nhiên kỹ thuật thực hiện sẽ khó khăn hơn.
- Đặt Kehr.
- Đặt stent qua u: đây là phương pháp ngày càng được sử dụng rộng rãi.
+ Về kỹ thuật, ít nhất có hai nghiên cứu gần đây cho thấy hiệu quả thông tắc cao hơn cũng như ít biến chứng viêm đường mật hơn của nhóm can thiệp qua da so với nhóm sử dụng ERCP [49], [50], tuy nhiên lại gây biến chứng rò mật hoặc chảy máu cao hơn, cũng như gây bất tiện hơn cho bệnh nhân.
+ Stent ống mật chủ hay stent một nhánh: Stent một nhánh có thể được sử dụng do thông thường chỉ có 25-30% thể tích gan cần được dẫn lưu để giảm tắc mật [51]. Tuy nhiên rủi ro không giải phóng hoàn toàn được đường mật cũng như biến chứng viêm đường mật vẫn cao hơn.
+ Stent nhựa và stent kim loại: một nghiên cứu tổng quan gần đây kết luận không loại nào cho thấy lợi thế về sống sót hơn so với loại còn lại, vì vậy những yếu tố tiếp theo có thể cân nhắc khi lựa chọn là kỳ vọng sống, chất lượng cuộc sống, chi phí và kinh nghiệm của chuyên gia [52]. Stent kim loại thường được sử dụng cho những bệnh nhân có kỳ vọng sống lớn hơn 3 tháng [41].
TÀI LIỆU THAM KHẢO
1. Esnaola N.F., Meyer J.E., Karachristos A., et al. (2016). Evaluation and management of intrahepatic and extrahepatic cholangiocarcinoma. Cancer, 122(9), 1349–1369.
2. Khan S.A., Tavolari S., and Brandi G. (2019). Cholangiocarcinoma: Epidemiology and risk factors. Liver Int Off J Int Assoc Study Liver, 39 Suppl 1, 19–31.
3. Allen P.J., Reiner A.S., Gonen M., et al. (2008). Extrahepatic cholangiocarcinoma: a comparison of patients with resected proximal and distal lesions. HPB, 10(5), 341–346.
4. Trịnh Hồng Sơn (2014), Những biến đổi giải phẫu gan, ứng dụng phẫu thuật, Nhà xuất bản Y học.
5. Nguyễn Văn Huy (2016), Giải phẫu người, Nhà xuất bản Y học.
6. Trịnh Bình (2007), Mô phôi học, Nhà xuất bản Y học.
7. Soares K.C., Kamel I., Cosgrove D.P., et al. (2014). Hilar cholangiocarcinoma: diagnosis, treatment options, and management. Hepatobiliary Surg Nutr, 3(1), 18–34.
8. de Groen P.C., Gores G.J., LaRusso N.F., et al. (1999). Biliary tract cancers. N Engl J Med, 341(18), 1368–1378.
9. Esposito I. and Schirmacher P. (2008). Pathological aspects of cholangiocarcinoma. HPB, 10(2), 83–86.
10. Kirstein M.M. and Vogel A. (2016). Epidemiology and Risk Factors of Cholangiocarcinoma. Visc Med, 32(6), 395–400.
11. Khan A.S. and Dageforde L.A. (2019). Cholangiocarcinoma. Surg Clin North Am, 99(2), 315–335.
12. Chamberlain R.S. and Blumgart L.H. (2000). Hilar cholangiocarcinoma: a review and commentary. Ann Surg Oncol, 7(1), 55–66.
13. Zhao J.-Z. and Wu B.-H. (1997). Clinical significance of CA19-9 in diagnosis of digestive tract tumors. World J Gastroenterol, 3(4), 253–254.
14. Yazawa S., Asao T., Izawa H., et al. (1988). The presence of CA19-9 in serum and saliva from Lewis blood-group negative cancer patients. Jpn J Cancer Res Gann, 79(4), 538–543.
15. Pavai S. and Yap S.F. (2003). The clinical significance of elevated levels of serum CA 19-9. Med J Malaysia, 58(5), 667–672.
16. Liang B., Zhong L., He Q., et al. (2015). Diagnostic Accuracy of Serum CA19-9 in Patients with Cholangiocarcinoma: A Systematic Review and Meta-Analysis. Med Sci Monit Int Med J Exp Clin Res, 21, 3555–3563.
17. Madhusudhan K.S., Gamanagatti S., and Gupta A.K. (2015). Imaging and interventions in hilar cholangiocarcinoma: A review. World J Radiol, 7(2), 28–44.
18. Hann L.E., Greatrex K.V., Bach A.M., et al. (1997). Cholangiocarcinoma at the hepatic hilus: sonographic findings. AJR Am J Roentgenol, 168(4), 985–989.
19. Neumaier C.E., Bertolotto M., Perrone R., et al. (1995). Staging of hilar cholangiocarcinoma with ultrasound. J Clin Ultrasound JCU, 23(3), 173–178.
20. Olthof S.-C., Othman A., Clasen S., et al. (2016). Imaging of Cholangiocarcinoma. Visc Med, 32(6), 402–410.
21. Young M. and Mehta D. (2020). Percutaneous Transhepatic Cholangiogram. StatPearls. StatPearls Publishing, Treasure Island (FL).
22. Spârchez Z. (2004). Echoguided percutaneous biliary drainage. Indications, performances, complications. Romanian J Gastroenterol, 13(2), 139–146.
23. Ruys A.T., Van Beem B.E., Engelbrecht M.R.W., et al. (2012). Radiological staging in patients with hilar cholangiocarcinoma: a systematic review and meta-analysis. Br J Radiol, 85(1017), 1255–1262.
24. Lee M.G., Lee H.J., Kim M.H., et al. (1997). Extrahepatic biliary diseases: 3D MR cholangiopancreatography compared with endoscopic retrograde cholangiopancreatography. Radiology, 202(3), 663–669.
25. Phelip J.-M., Vendrely V., Rostain F., et al. (2014). Gemcitabine plus cisplatin versus chemoradiotherapy in locally advanced biliary tract cancer: Fédération Francophone de Cancérologie Digestive 9902 phase II randomised study. Eur J Cancer Oxf Engl 1990, 50(17), 2975–2982.
26. Fuller C.D., Dang N.D., Wang S.J., et al. (2009). Image-guided intensity-modulated radiotherapy (IG-IMRT) for biliary adenocarcinomas: Initial clinical results. Radiother Oncol J Eur Soc Ther Radiol Oncol, 92(2), 249–254.
27. Glimelius B., Hoffman K., Sjödén P.O., et al. (1996). Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer. Ann Oncol Off J Eur Soc Med Oncol, 7(6), 593–600.
28. Sharma A., Dwary A.D., Mohanti B.K., et al. (2010). Best supportive care compared with chemotherapy for unresectable gall bladder cancer: a randomized controlled study. J Clin Oncol Off J Am Soc Clin Oncol, 28(30), 4581–4586.
29. Valle J., Wasan H., Palmer D.H., et al. (2010). Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med, 362(14), 1273–1281.
30. Okusaka T., Nakachi K., Fukutomi A., et al. (2010). Gemcitabine alone or in combination with cisplatin in patients with biliary tract cancer: a comparative multicentre study in Japan. Br J Cancer, 103(4), 469–474.
31. Valle J.W., Furuse J., Jitlal M., et al. (2014). Cisplatin and gemcitabine for advanced biliary tract cancer: a meta-analysis of two randomised trials. Ann Oncol Off J Eur Soc Med Oncol, 25(2), 391–398.
32. Lamarca A., Hubner R.A., David Ryder W., et al. (2014). Second-line chemotherapy in advanced biliary cancer: a systematic review. Ann Oncol Off J Eur Soc Med Oncol, 25(12), 2328–2338.
33. Gruenberger B., Schueller J., Heubrandtner U., et al. (2010). Cetuximab, gemcitabine, and oxaliplatin in patients with unresectable advanced or metastatic biliary tract cancer: a phase 2 study. Lancet Oncol, 11(12), 1142–1148.
34. Malka D., Cervera P., Foulon S., et al. (2014). Gemcitabine and oxaliplatin with or without cetuximab in advanced biliary-tract cancer (BINGO): a randomised, open-label, non-comparative phase 2 trial. Lancet Oncol, 15(8), 819–828.
35. Moehler M., Maderer A., Schimanski C., et al. (2014). Gemcitabine plus sorafenib versus gemcitabine alone in advanced biliary tract cancer: a double-blind placebo-controlled multicentre phase II AIO study with biomarker and serum programme. Eur J Cancer Oxf Engl 1990, 50(18), 3125–3135.
36. Valle J.W., Wasan H., Lopes A., et al. (2015). Cediranib or placebo in combination with cisplatin and gemcitabine chemotherapy for patients with advanced biliary tract cancer (ABC-03): a randomised phase 2 trial. Lancet Oncol, 16(8), 967–978.
37. Houghton E. (2019). Complex percutaneous biliary procedures: Review and contributions of a high volume team. Int J Gastrointest Interv, 8(1), 10–19.
38. Dumonceau J.-M., Tringali A., Papanikolaou I.S., et al. (2018). Endoscopic biliary stenting: indications, choice of stents, and results: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline – Updated October 2017. Endoscopy, 50(9), 910–930.
39. Kloek J.J., Ten Kate F.J., Busch O.R.C., et al. (2008). Surgery for extrahepatic cholangiocarcinoma: predictors of survival. HPB, 10(3), 190–195.
40. Tsao J.I., Nimura Y., Kamiya J., et al. (2000). Management of hilar cholangiocarcinoma: comparison of an American and a Japanese experience. Ann Surg, 232(2), 166–174.
41. Valle J.W., Borbath I., Khan S.A., et al. (2016). Biliary cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up †. Ann Oncol, 27, v28–v37.
42. Nakeeb A., Pitt H.A., Sohn T.A., et al. (1996). Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors. Ann Surg, 224(4), 463–475.
43. Rajagopalan V., Daines W.P., Grossbard M.L., et al. (2004). Gallbladder and biliary tract carcinoma: A comprehensive update, Part 1. Oncol Williston Park N, 18(7), 889–896.
44. Ebata T., Nagino M., Kamiya J., et al. (2003). Hepatectomy with portal vein resection for hilar cholangiocarcinoma: audit of 52 consecutive cases. Ann Surg, 238(5), 720–727.
45. Hemming A.W., Reed A.I., Fujita S., et al. (2005). Surgical Management of Hilar Cholangiocarcinoma. Ann Surg, 241(5), 693–702.
46. Burke E.C., Jarnagin W.R., Hochwald S.N., et al. (1998). Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system. Ann Surg, 228(3), 385–394.
47. Zhang W. and Yan L.-N. (2014). Perihilar cholangiocarcinoma: Current therapy. World J Gastrointest Pathophysiol, 5(3), 344–354.
48. Lim J.H., Choi G.H., Choi S.H., et al. (2013). Liver resection for Bismuth type I and Type II hilar cholangiocarcinoma. World J Surg, 37(4), 829–837.
49. Saluja S.S., Gulati M., Garg P.K., et al. (2008). Endoscopic or percutaneous biliary drainage for gallbladder cancer: a randomized trial and quality of life assessment. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc, 6(8), 944-950.e3.
50. Piñol V., Castells A., Bordas J.M., et al. (2002). Percutaneous self-expanding metal stents versus endoscopic polyethylene endoprostheses for treating malignant biliary obstruction: randomized clinical trial. Radiology, 225(1), 27–34.
51. Dowsett J.F., Vaira D., Hatfield A.R., et al. (1989). Endoscopic biliary therapy using the combined percutaneous and endoscopic technique. Gastroenterology, 96(4), 1180–1186.
52. Levy M.J., Baron T.H., Gostout C.J., et al. (2004). Palliation of malignant extrahepatic biliary obstruction with plastic versus expandable metal stents: An evidence-based approach. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc, 2(4), 273–285.
 UNG THƯ HỌC
UNG THƯ HỌC
